La configuración electrónica es la ubicación de los electrónes en un átomo.
Esta configuración se mide por subniveles energéticos los cuales son:
s,p,d y f.
Además esta configuración funciona con las reglas de los orbitales y su capacidad de los electrónes de cada uno, Es decir cuantos electrones puede tener cada orbital (los mismos que los subniveles s,p,d,f).
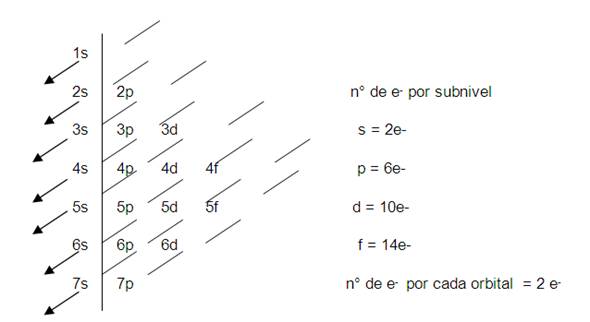
S: 2 e-
P:6 e-
D: 10 e-
F: 14e-
Esta configuración tiene niveles energéticos(no es lo mismo que los subniveles) que son: 1,2,3,4,5,6,7
Con esos niveles energéticos funciona la regla de los electrónes de valencia que dice que son los electrónes ubicados en el ultimo nivel energético de cada Átomo.
Para hacer los ejercicios hay que saber primero los electrónes del elemento y saber cuanta capacidad tiene cada orbital como maximo para almacenar electrónes, y ahi solo hay que seguir el orden de las flechas mostrada en la imagen, seria 1s2 2s2 2p6 3s2.... etc se coloca el numero al lado por los electrónes de ese orbital entonces 1s2 porque el orbital s tiene como máximo 2 electrónes(Ojo tambien se pueden colocar menos electrónes en los orbitales como mostramos en el siguiente ejemplo)
Ej: El carbono tiene configuración electrónica 1s2 2s2 2p2 entonces tiene 4 electrónes de valencia porque ubieron 4 e- en el ultimo nivel es decir en el nivel 2 1s2 (2s2 2p2).
Como ven el orbital p tiene para 6 e- y yo coloque dos ¿Porque? porque el carbono solo tiene 6 electrones en total y si contamos hay 2 e- en el nivel 1s hay 2- en el nivel 2s y hay 2 e- en el nivel 2p entonces nos daría 6 electrónes en total justo los que corresponde al carbono(si colocamos más electrónes seria ion).
No hay comentarios:
Publicar un comentario